Banyak
ion logam dapat ditentukan dengan titrasi menggunakan suatu pereaksi (sebagai
titran) yang dapat membentuk kompleks dengan logam tersebut. Salah satu senyawa
komplek yang biasa digunakan sebagai penitrasi dan larutan standar adalah ethylene diamine tetra acetic acid
(EDTA)
EDTA merupakan asam lemah dengan empat proton. Bentuk asam dari EDTA dituliskan sebagai H4Y dan reaksi netralisasinya adalah sebagai berikut :
Sebagai penitrasi/pengomplek logam, biasanya yang digunakan yaitu garam Na2EDTA (Na2H2Y), karena EDTA dalam bentuk H4Y dan NaH3Y tidak larut dalam air. EDTA dapat mengomplekkan hampir semua ion logam dengan perbandingan mol 1 : 1 berapa pun bilangan oksidasi logam tersebut.
Kestabilan
senyawa komplek dengan EDTA, berbeda antara satu logam dengan logam yang lain.
Reaksi pembentukan komplek logam (M) dengan EDTA (Y) adalah :
M
+ Y → MY
Konstanta
pembentukan/kestabilan senyawa komplek dinyatakan sebagai berikut ini :
Besarnya harga konstanta pembentukan komplek menyatakan tingkat kestabilan suatu senyawa komplek. Makin besar harga konstanta pembentukan senyawa komplek, maka senyawa komplek tersebut makin stabil dan sebaliknya makin kecil harga konstanta kestabilan senyawa komplek, maka senyawa komplek tersebut makin tidak (kurang) stabil.
Harga
konstanta kestabilan komplek logam dengan EDTA (KMY) (Fritz dan Schenk, 1979).
Karena
selama titrasi terjadi reaksi pelepasan ion H + maka larutan yang
akan dititrasi perlu ditambah larutan buffer (untuk menstabilkan pH).
Untuk
menentukan titik akhir titrasi ini digunakan indikator, diantaranya Calmagite, Arsenazo,
Eriochrome Black T (EBT). Sebagai contoh titrasi antara Mg2+ dengan
EDTA sebagai penitrasi, menggunakan indikator Calmagite.
Reaksi
antara ion Mg2+ dengan EDTA tanpa adanya penambahan indikator :
Mg2+
+ H2Y2- ???
MgY2-
+ 2H+
Jika
sebelum titrasi ditambahkan indikator maka indikator akan membentuk kompleks
dengan Mg2+ (berwarna merah) kemudian Mg2+ pada komplek
akan bereaksi dengan EDTA yang ditambahkan. Jika semua Mg2+ sudah
bereaksi dengan EDTA maka warna merah akan hilang selanjutnya kelebihan sedikit
EDTA akan menyebabkan terjadinya titik akhir titrasi yaitu terbentuknya warna
biru.
Kestabilan
termodinamik dari suatu spesi merupakan ukuran sejauh mana spesi ini akan
terbentuk dari spesi-spesi lain pada kondisi-kondisi tertentu, jika sistem itu
dibiarkan mencapai keseimbangan.
Faktor-faktor
yang mempengaruhi kestabilan kompleks, yaitu :
a.
Kemampuan mengkompleks
logam-logam.
Kemampuan
mengkompleks relatif (dari) logam-logam digambarkan dengan baik menurut klarifikasi
Schwarzenbach, yang dalam garis besarnya didasarkan atas pembagian logam
menjadi asam Lewis (penerima pasangan elektron) kelas A dan kelas B.
b. Ciri-ciri khas ligan :
Di
antara ciri-ciri khas ligan yang umum diakui sebagai mempengaruhi kestabilan
kompleks dalam mana ligan itu terlibat, adalah :
1. kekuatan basa dari ligan itu
2. sifat-sifat penyepitan (jika ada)
3. efek-efek sterik (ruang)
Keinertan
atau kelabilan kinetik dipengaruhi oleh banyak faktor, tetapi pengamatan umum
berikut ini merupakan pedoman yang baik akan perilaku kompleks-kompleks dari
berbagai unsur, yaitu diantaranya :
- Unsur grup utama, biasanya membentuk kompleks-kompleks labil.
- Dengan pengecualian Cr(III) dan Co(III), kebanyakan unsur transisi baris pertama, membentuk kompleks-kompleks labil.
- Unsur transisi baris kedua dan baris ketiga, cenderung membentuk kompleks-kompleks inert.
Suatu reaksi kompleks dapat dipakai dalam penitaran apabila :
1. Kompleks cukup memberikan perbedaan pH yang cukup besar pada daerah
titik setara.
2. Terbentuknya cepat.
Beberapa
jenis senyawa Kompleks
Ada 2
jenis ligan dilihat dari jumlah atom donor di dalamnya :
1. Ligan monodentat : terdapat 1
atom di dalamnya
2. Ligan polidentat : terdapat lebih dari 1 atom donor di dalamnya
Contoh beberapa komplekson :
1. Asam nitrilotriasetat (III), Nama lainnya adalah :
- NITA
- NTA
- Komplekson I
2. Asam trans-1,2-diaminosikloheksana-N,N,N’,N’-tetraasetat (IV), Nama
lainnya adalah:
- EDTA
- DcyTA
- DCTa
- Komplekson IV
3. Asam 2,2’2 etilenadioksibis (etiliminodiasetat) (V), Nama lainnya:
- Asam etilenaglikolbis (2-aminoetil eter) N,N,N’,N-tetraasetat (EGTA)
4. Asam trietilenatetramina-N,N,N’,N”,N”’,N”’-heksaasetat (TTHA)
Jenis-jenis
titrasi EDTA, yaitu :
1. Titrasi langsung
2. Titrasi balik
3. Titrasi penggantian atau titrasi substitusi
4. Titrasi alkalimetri
5. Titrasi tidak langsung
Kurva
pada titrasi EDTA dibuat dengan memplot pM (logaritma negatif dari
konsentrasi ion logam bebas : pM = -log[Mn+]) pada sumbu y dan
volume larutan EDTA yang ditambahkan pada sumbu x.
Faktor-faktor
yang akan membantu menaikkan selektivitas, yaitu :
a. Dengan mengendalikan pH larutan dengan sesuai
b. Dengan menggunakan zat-zat penopeng
c. Kompleks-kompleks sianida
d. Pemisahan secara klasik
e. Ekstraksi pelarut
f.
Indikator
g. Anion-anion
h. Penopengan Kinetik
Macam-macam
indikator logam, yaitu diantaranya :
- Mureksida (C.I. 56085)
- Hitam Solokrom (Hitam Eriokrom T)
- Indikator Patton dan Reeder
- Biru Tua Solokrom atau Kalkon
- Kalmagit
- Kalsikrom (calcichrome)
- Hitam Sulfon F Permanen (C.I. 26990)
- Violet Katekol (Catechol Violet) atau Violet Pirokatekol (Pyrocatechol Violet)
- Merah Bromopirogalol (Bromopyrogalol Red)
- Jingga Xilenol (Xylenol Orange)
- komplekson Timolftalein (Timolftalein)
- Biru Metiltimol (Komplekson Biru Metiltimol)
- Zinkon (Zincon) atau 1-(2-hidroksi-5-sulfofenil)-3-fenil-5-(2-karboksifenil)-formazan
- Biru Variamina (C.I. 37255)
Kesalahan
titrasi kompleksometri tergantung pada cara yang dipakai untuk mengetahui titik
akhir. Pada prinsipnya ada dua cara, yaitu kelebihan titran yang pertama
ditunjukkam atau berkurangnya konsentrasi komponen tertentu sampai batas yang
ditentukan, dideteksi.
1. Kesalahan titrasi dihitung dengan cara yang sama pada titrasi
pengendapan.
2. Digunakan senyawa yang membentuk senyawa kompleks yang berwarna tajam
dengan logam yang ditetapkan. Warna ini hilang atau berubah sewaktu logam telah
diikat menjadi kompleks yang lebih stabil. Misalnya EDTA.
INTISARI
:
Titrasi kompleksometri adalah suatu analisis volumetri
berdasarkan reaksi pembentukan senyawa kompleks antara ion logam (Baku Primer)
dengan zat pembentuk kompleks /ligan/ khelat (Baku Sekunder).
Ciri kompleksometri yang paling mudah untuk
mengenalinya yaitu memiliki pasangan elektron bebas pada ligan.
Ligan adalah gugus yang terikat pada ion pusat.
Indikator yang sering digunakan dalam titrasi
kompleksometri yaitu, Eriochrom Black T (EBT), Murexide.

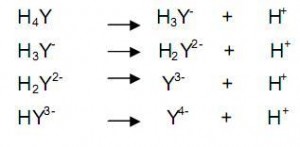



Tidak ada komentar:
Posting Komentar